成果一
近日,永利总站ylzz55“肿瘤免疫靶向治疗”科研团队在药剂学著名期刊Journal of Controlled Release(中科院一区,IF:10.8)上发表题为“Targeted co-delivery of resiquimod and a SIRPα variant by liposomes to activate macrophage immune responses for tumor immunotherapy”的研究论文。这是我院第一次以第一单位在该期刊发表论文,是我院在药剂学研究领域的重要突破。

该研究进一步构建了一种共递送R848和CV1的多功能脂质体(命名为:R-LS/M/CV1),并在脂质体表面修饰甘露糖,赋予其对TAMs的靶向性。体外实验表明,R-LS/M/CV1对M2巨噬细胞具有很强的靶向、再教育和促吞噬作用。体内实验表明,瘤内给予R-LS/M/CV1可通过诱导TAMs的再极化、促吞噬和募集肿瘤浸润T细胞,根除多数的小鼠结肠癌移植瘤。更令人鼓舞的是,由于甘露糖和CV1蛋白对TAMs和肿瘤细胞的双重靶向作用,系统给药R-LS/M/CV1可靶向积累于肿瘤组织,不仅有效抑制小鼠肿瘤生长,而且不产生血液和组织器官毒性。该研究基于TAMs“再教育”和CD47阻断的综合策略,构建新型多功能脂质体药物,为CD47/SIRPα免疫检查点的药物开发提供了新的见解和思路。
药学院“肿瘤免疫靶向治疗”科研团队贾殿隆博士和2020级硕士研究生路岳为论文的共同第一作者,李军副教授为论文通讯作者。该研究得到了山东省自然科学基金(ZR2020KH019, ZR2021LSW001和ZR2021MC017),国家自然科学基金(82000066)和永利总站ylzz55“光岳青年学者创新团队”基金(LCUGYTD2022-04)的支持。
成果二
永利总站ylzz55药学院王帅博士与中国医学科学院药物研究所戴均贵研究员团队合作以共同第一和通讯作者身份在国际顶级化学期刊Angewandte Chemie International Edition (Top Journals,IF: 16.6)在线发表了题为“Functional Characterization and Cyclization Mechanism of a Diterpene Synthase Catalyzing the Skeleton Formation of Cephalotane-type Diterpenoids”的研究论文。该研究发现并功能鉴定了三尖杉烯合酶CsCTS,首次明确了海南粗榧内酯等三尖杉烷型二萜前体为三尖杉烯(cephalotene),并阐明了其环化机制。
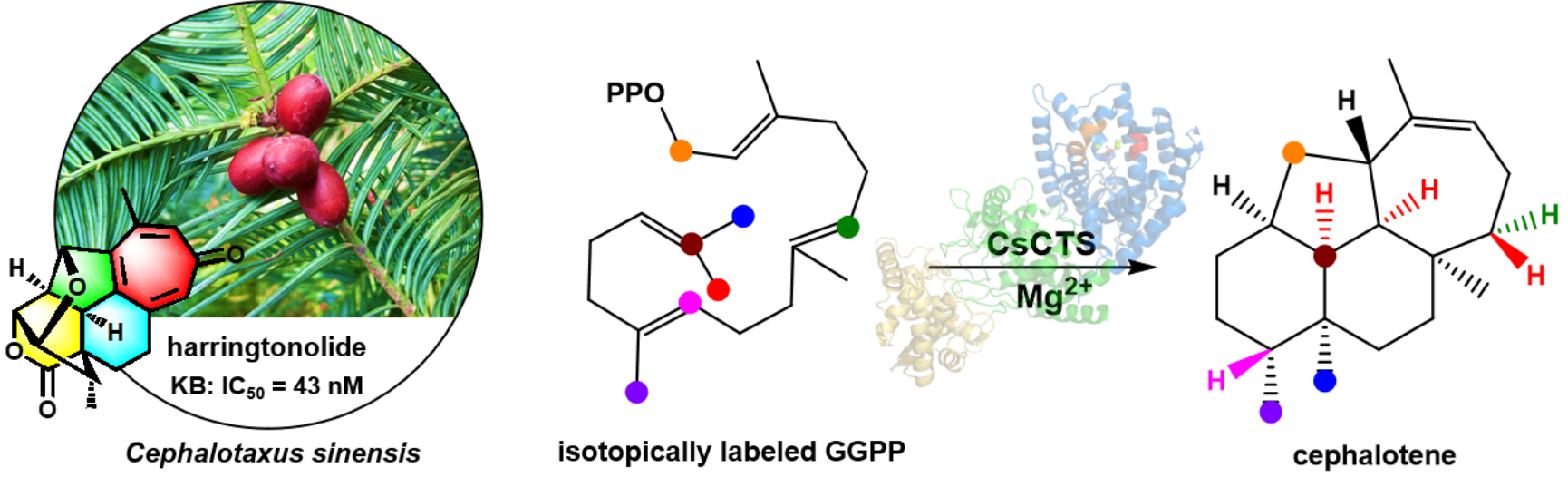
海南粗榧内酯(harringtonolide)是三尖杉属Cephalotaxus植物中cephalotane-type二萜的代表性成分,具有一个刚性骈合的6/6/5/7四环二萜骨架、一个六元内酯桥环和一个四氢呋喃环,分子中共有7个手性中心,骨架新颖独特,具有多种生物活性,尤其对人KB细胞的IC50值达43 nM,极具研发前景。但该化合物的生物合成研究未见报道,其二萜合酶、二萜烯骨架及其环化机制仍是谜团。
该研究从粗榧(C. sinensis)中发现了一个I型二萜合酶能够产生一个主产物和四个脱轨产物,经NMR、化学衍生和X-射线单晶衍射分析确定了主产物的结构为三尖杉烯,从而鉴定了该酶的功能,并命名为三尖杉烯合酶CsCTS (Cephalotaxussinensis Cephalotene Synthase)。为阐明CsCTS催化机制,作者首先通过分离鉴定脱轨产物结构提出了可能的环化机制,进一步经同位素标记实验和密度泛函理论计算证明了CsCTS的催化机制。最后,结合分子对接、点突变和分子动力学模拟等技术手段,阐明了调控环化过程关键的氢迁移、甲基迁移的关键氨基酸残基,以及CsCTS/TbTS同源酶的进化关系,显示了自然界中植物-基因/酶-途径-代谢产物之间的演化关联性。
该研究发现并鉴定了海南粗榧内酯等三尖杉烷型二萜生物合成第一步反应相关二萜合酶,阐明了其催化机制,为破译和人工构建海南粗榧内酯等三尖杉烷型二萜完整生物合成途径奠定了基础。
王帅博士为论文共同第一作者和共同通讯作者,中国医学科学院药物研究所博士生李常康为论文第一作者,中国医学科学院药物研究所戴均贵研究员为通讯作者。该项目得到了国家重点研发计划(2020YFA0908000)、山东省自然科学基金(ZR2019PC030)及中国医学科学院医学与健康科技创新工程(CIFMS-2022-I2M-2-002)的支持。